疾病控制率100%!创新双抗治疗胃癌,值得中国百万患者期待
 胃癌
|
阅读量:200次
胃癌
|
阅读量:200次
近日,双特异性抗体Zanidatamab将进入全球3期临床试验,评估其一线治疗HER2阳性胃食管腺癌(GEA)患者的疗效。
而此前,在一项2期研究中,Zanidatamab联合化疗最高达到了100%的疾病控制率和93%的客观缓解率。
01/ 胃癌大国,需要更好疗法
胃癌是全球第五大最常见的癌症,也是癌症死亡的第三大原因。
目前,全球每年胃癌确诊病例超过100万,死亡近80万,其中一半在中国,几乎占据了全球胃癌确诊和死亡人数的“半壁江山”。
约有20%的胃癌患者HER2呈阳性,对这类患者来说,靶向治疗是首选治疗方案。
今年8月,抗体偶联药Enhertu在日本获批,用于治疗HER2阳性、无法切除的晚期复发性或转移性胃癌患者。
不过,HER2阳性GEA具有较高的发病率和死亡率,患者迫切需要新的治疗方案。
02/ 双特异性抗体:Zanidatamab
Zanidatamab(ZW25)是一种双特异性抗体,可以同时结合HER2的两个非重叠表位。

这种独特的结合可以产生多种作用机制,包括双重HER2信号阻断、增加HER2蛋白从细胞表面的去除,以及提高细胞毒性作用,从而促进在患者中产生抗肿瘤活性。
目前,该药的临床试验正在全球多地进行中,作为表达HER2的实体瘤患者的靶向治疗选择。
先前,FDA还授予Zanidatamab 两个快速通道称号,一个是单药治疗难治性BTC患者,另一个是联合标准化疗一线治疗胃食管腺癌(GEA)患者。
去年12月,FDA还授予Zanidatamab“突破性疗法”称号,用于治疗先前接受过治疗的HER2基因扩增的胆道癌(BTC)患者。
值得一提的是,根据我国国家药监局药品审评中心(CDE)公示,Zanidatamab已在中国获批启动多项研究,包括一线治疗晚期HER2阳性乳腺癌或胃食管腺癌、单药治疗HER2阳性的局部晚期不可切除或转移性胆道癌等。
03/ 疾病控制率高达100%,Zanidatamab联合化疗值得期待!
HERIZON-GEA-01是一项随机、全球3期研究,旨在评估Zanidatamab联合化疗,联合或不联合替雷利珠单抗,与曲妥珠单抗+化疗相比,晚期或转移性HER2阳性在胃食管腺癌患者中的疗效和安全性。
该试验将在38个国家/地区招募约700名患者,包括欧洲、北美和南美、亚洲和澳大利亚等。主要终点是无进展生存期和总生存期。
此前,在今年9月份举行的欧洲医学肿瘤学会年会上,一项2期临床研究的积极数据公布。在这项研究中,入组的36名HER2阳性的GEA患者接受Zanidatamab联合化疗治疗,包括CAPOX (n=14)、FP(n=2)或mFOLFOX6 (n=20),这些患者既往未接受过HER2靶向治疗。
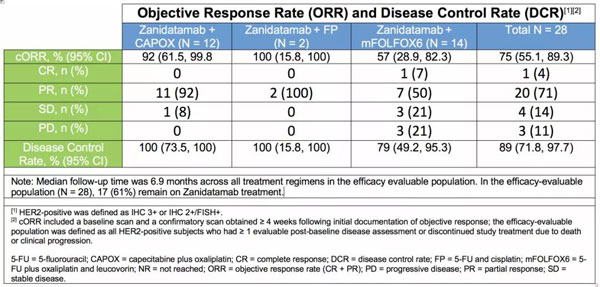
结果显示:
· 在28名可评估疗效的转移性HER2阳性GEA患者中,Zanidatamab联合化疗确认的总客观缓解率(cORR)为75%,疾病控制率(DCR)为89%;
其中,接受Zanidatamab+CAPOX/FP治疗的患者cORR为93%,DCR高达100%。
· 除一名患者外,所有患者的肿瘤体积均有所减少。
· 在所有治疗方案中,中位缓解持续时间为16.4个月,中位无进展生存期为12个月,在数据截止时,61%的患者仍在研究中。
此外,Zanidatamab+化疗的安全性和耐受性良好,无严重的治疗相关不良事件。
第2阶段数据证明,Zanidatamab一线治疗胃食管腺癌中优势显著,其缓解率和持久性均优于当前标准疗法或新兴疗法。
未来3年内,Zanidatamab将递交两项潜在的生物制剂许可申请,期待该药能早日获批,为全球HER2阳性胃癌患者带来更好的新疗法。
想了解更多胃癌新疗法相关信息,请在微信后台或下方小程序留言咨询,也可致电好医友热线(400-060-9693)。
2021-11-12 11:35

好医友小编
联系医学顾问
医学顾问微信在线
