盘点丨2021年最值得期待的10个肺癌新药!
 肺癌
|
阅读量:200次
肺癌
|
阅读量:200次
2021年伊始,好医友为大家送上最靠谱的干货信息!
回顾整个2020年,肺癌的治疗方案可谓是发生了翻天覆地的变化,不仅出现了越来越多的新的靶向药、免疫药物,其以往获批的药物也扩增了新的适应症,前几日医保目录的更新也为肺癌患者带来了新的希望。
2021年又有哪些肺癌新药值得期待,进入今天最全药物大盘点!
一、靶向药物
1、恩沙替尼
2020年的11月19日,恩沙替尼在国内获批上市,其获批的适应症为:用于接受过克唑替尼治疗后进展的或者对克唑替尼不耐受的ALK阳性的局部晚期或转移性非小细胞肺癌患者提供新的治疗。
它是我国首个国产二代AKL抑制剂,其获批的主要依据是一项关于恩沙替尼治疗克唑替尼耐药的间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌患者疗效和安全性的Ⅱ期单臂、多中心临床研究。
研究显示,接受恩沙替尼治疗的患者客观缓解率(ORR)为52.6%,疾病控制率(DCR)为87.8%,中位无进展生存期(mPFS)为11.2个月。即便对于肺癌出现脑转移的患者,恩沙替尼依然展现出来良好的治疗效果,其颅内客观缓解率(ORR)为71.4%,颅内病灶控制率达95.2%,且患者耐受良好,安全性可控。
恩沙替尼的获批为ALK突变患者的二线治疗带来了新的希望,特别是对于脑转移患者,恩沙替尼有着更高的应答率且安全性更优。值得注意的是,目前恩沙替尼也正计划申请国内的一线治疗,让我们拭目以待吧。
2、阿美替尼
2020年3月18日,国产药阿美替尼在国内获批上市,其适应症为:用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗进展,且T790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗。
无论从疗效还是安全性表现来看,阿美替尼都可以作为非小细胞肺癌患者二线治疗一种新的治疗选择。
二、免疫药物
1、卡瑞利珠单抗
去年唯一一个在国内上市的免疫单药就是国产的卡瑞利珠单抗。
卡瑞利珠单抗,商品名艾瑞卡,2020年6月19日,卡瑞利珠单抗在国内获批用于联合培美曲塞、卡铂一线治疗EGFR/ALK阴性的、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌患者。
一项名为CameL的Ⅲ期临床数据显示,卡瑞利珠单抗联合化疗组的客观缓解率达到了60%,提高了20%,无进展生存期达到了11.3个月,明显优于对照组。2020年12月19日,更新的生存数据显示,其中位总生存期(mOS)达到了27.9个月,成功突破了两年大关。
另外,卡瑞利珠单抗也成功进入此次医保目录,这对于广大的肺癌患者来讲,不得不说是一个年终惊喜。
2、阿替利珠单抗联合化疗获批一线小细胞肺癌
2020年2月,中国NMPA批准了阿替利珠单抗(商品名:泰圣奇)联合化疗(卡铂+依托泊苷),一线治疗广泛期小细胞肺癌(ES-SCLC)患者,阿替利珠单抗是我国第二个上市的PD-L1抑制剂,也是首个应用于小细胞肺癌的免疫药物。
此次获批的依据来源于III期IMpower133研究,试验结果显示,与单一化疗相比,联合方案组显著延长了总生存期(中位OS:12.3个月 vs 10.3个月),将疾病进展或死亡风险显著降低了23%(中位PFS:5.2个月 vs 4.3个月)。
随访研究表明,在第18个月,联合治疗组的OS率为34%,单纯化疗组的OS率则为21%,且联合治疗组的不良反应安全可靠。
联合方案的获批,为我国小细胞肺癌患者带来了一项新的治疗选择,值得一提的是,这是20多年来ES-SCLC一线治疗方面首次具有临床意义的进步。
三、未来的期望
说完了国内,我们再来看看国外有哪些新的药物获批上市。
01.非小细胞肺癌
①MET抑制剂新药-Tepotinib(特普替尼)和 capmatinib(卡马替尼)
作为全球首款MET抑制剂,Tepotinib最早于2020年3月在日本获批上市。而在2020年8月,美国FDA授予了其优先审查资格,用于治疗MET14外显子跳跃突变(MET ex14)的转移性非小细胞肺癌患者。
临床试验显示Tepotinib在MET ex14的非小细胞肺癌患者中表现优异,客观缓解率(ORR)为46%,疾病控制率(DCR)为65.7%,中位持续缓解时间为(mDOR)11.1个月。
2020年5月7日,美国FDA批准capmatinib(Tabrecta)用于治疗携带MET外显子14跳跃(MET exon14 skipping,METex14)突变的转移性非小细胞肺癌(NSCLC)成人患者,包括一线治疗(初治)患者和先前接受过治疗(经治)的患者。
临床数据显示,对于初治患者,capmatinib的总缓解率(ORR)达到了68%,中位持续缓解时间(DCR)达到了12.6个月;而在经治患者中,ORR也达到了41%,且不良反应安全可控。
这些结果揭示了Tabrecta在携带MET外显子14跳跃突变NSCLC患者中的治疗潜力,希望早日在国内获批。
②RET突变新药—普拉替尼
2020年9月4日,新型肺癌靶向药普拉替尼(Pralsetinib)经美国FDA批准上市,用于治疗RET融合基因突变阳性的转移性非小细胞肺癌成人患者。而在9月7日,普拉替尼就在国内进行了上市申请,并纳入了优先审评,其申请的适应症为:治疗经含铂化疗的RET融合阳性的非小细胞肺癌患者。
此次申请的依据在于一项Ⅰ/Ⅱ期ARROW的临床试验,在87例曾接受过含铂化疗的患者中,客观缓解率(ORR)为57%;而在26例未接受过含铂化疗的初治患者中,ORR为70%。
可以看出,无论是初治还是经治,其都表现出了不错的治疗效果,期待它在国内上市。
③首个KRAS突变的靶向药递交上市申请
2020年12月9日,美国FDA授予在研KRAS G12C抑制剂Sotorasib(AMG 510)突破性疗法认定,用于治疗局部晚期或转移性携带KRAS G12C突变的非小细胞肺癌(NSCLC)患者。
2020年12月16日,安进公司宣布向FDA递交AMG 510的上市申请,用于治疗KRAS G12C突变的晚期转移性非小细胞肺癌(NSCLC)。
2020年9月发表在《新英格兰医学杂志》上的试验数据显示,AMG 510达到32.2%的客观缓解率(ORR)和88.1%的疾病控制率(DCR),中位无进展生存期为6.3个月。
④雷莫芦单抗联合厄洛替尼获批一线
2020年5月,美国FDA批准了雷莫芦单抗联合厄洛替尼一线治疗表皮生长因子受体(EGFR)第19号外显子缺失或第21号外显子L858R突变的转移性非小细胞肺癌(NSCLC)患者。
其获批的依据来源于一项名为RELAY研究的Ⅲ期临床试验。研究显示。在449例未经治疗的转移性非小细胞肺癌患者中,雷莫卢单抗联合厄洛替尼相对于安慰剂联合ERL的无进展生存期得到了显著提高(中位PFS:19.4个月 VS 12.4个月),且联合用药的安全性良好。
⑤“O+Y”获批无突变类型的一线治疗
2020年5月28日,美国FDA批准“O+Y”(纳武利尤单抗+伊匹木单抗)联合2周期的含铂双药化疗,作为无EGFR或ALK基因组肿瘤异常、肿瘤表达PD-L1≥1%的转移性NSCLC成人患者的一线治疗方案。至此,该组合疗法已获批用于无论PD-L1表达相关性的鳞状或非鳞状癌症患者。
其获批是基于一项名为CheckMate-9LA的多中心Ⅲ期临床试验,结果发现,无论患者PD-L1表达或肿瘤组织学如何,“O+Y”联合两周期的含铂双药化疗显示出优于单纯化疗的OS,两组的mOS分别为15.6个和10.9个月,在一年的时间中,接受Opdivo+Yervoy联合有限疗程的含铂化疗的OS率为63%,接受含铂化疗患者的OS率为47%。
⑥布加替尼获批ALK的一线治疗
2020年5月23日,美国FDA正式批准布加替尼单药一线治疗间变性淋巴瘤激酶阳性(ALK+)转移性非小细胞肺癌(NSCLC)成人患者。
此次获批的依据来源于一项名为ALTA 1L的Ⅲ期临床数据,研究显示,与以往标准治疗相比,研究者评估布加替尼无进展生存期显著优于克唑替尼(中位PFS:29.4个月 vs 9.2个月)、将疾病进展或死亡风险降低51%。
它的获批也为ALK肺癌患者带来了一项新的选择,期待早日在国内上市。
⑦不限癌种靶向药—selpercatinib获批
2020年5月9日,美国FDA批准selpercatinib(Retevmo)用于治疗肿瘤在特定基因(转染期间重排基因,RET基因)存在基因改变(突变或融合)的3种类型肿瘤患者:非小细胞肺癌(NSCLC)、甲状腺髓样癌(MTC)、其他类型的甲状腺癌。
selpercatinib也是第一个被批准专门用于携带RET基因改变的癌症患者的治疗药物。临床试验显示,105例经治患者中,ORR为64%,81%的应答患者DOR≥6个月。39例初治患者中,ORR为84%,58%的应答患者DOR≥6个月。且具有良好的入脑效果,在11例存在基线脑转移的经治患者中,颅内缓解率(CNS-ORR)为91%(n=10/11),全部10例缓解患者的颅内缓解持续时间(CNS-DOR)≥6个月。
⑧阿替利珠单抗单药获批一线
2020年5月19日,阿替利珠单抗获美国FDA批准,作为一线(初始)单药疗法,用于治疗转移性非小细胞肺癌(NSCLC)成人患者,具体为:由FDA批准的一款检测方法确定肿瘤具有PD-L1高表达(PD-L1染色≥50%的肿瘤细胞[TC≥50%]或PD-L1染色肿瘤浸润[IC]覆盖≥10%的肿瘤面积[IC≥10%])、无EGFR或ALK突变的晚期非鳞状和鳞状非小细胞肺癌(NSCLC)成人患者。
此次批准,基于III期IMpower110研究的结果,试验显示,在PD-L1高表达(TC3/IC3-WT)患者中,与化疗相比,Tecentriq单药一线治疗将总生存期(OS)显著提高了7.1个月(中位OS:20.2个月 vs 13.1个月),且不良反应安全可控。
⑨奥希替尼获批术后辅助治疗
12月21日,奥希替尼被美国FDA获批,作为一种辅助(术后)疗法,用于治疗已接受治愈目的的完全肿瘤切除术的早期(IB/II/IIIA期)表皮生长因子受体突变(EGFRm)非小细胞肺癌(NSCLC)成人患者,国内适应症申请正在进行审查。
这次获批的依据在于一项Ⅲ期ADAURA研究,试验数据显示:在已接受完全肿瘤切除术的早期(IB/II/IIIA期)EGFRm-NSCLC患者中,与安慰剂相比,奥希替尼用于术后辅助治疗显著延长了无病生存期(DFS)、将疾病复发或死亡风险显著降低80%。
这也是全球首个证实有潜力改变早期EGFR突变肺癌的进程的靶向药物,为这些患者提供了治愈的希望。
02.小细胞肺癌
①肿瘤创新药—Zepzelca(lurbinectedin)
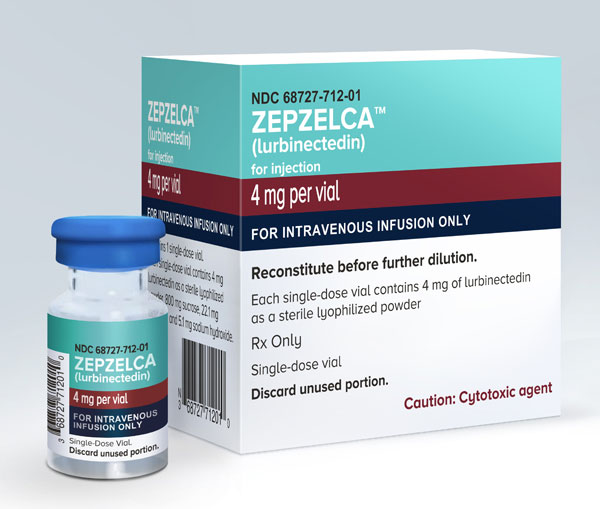
2020年6月,美国FDA批准了Zepzelca(lurbinectedin)用于接受含铂化疗期间或之后疾病进展的转移性小细胞肺癌(SCLC)患者。和其他靶向药或者免疫药不同,Zepzelca是一种海鞘素衍生物,为肿瘤创新药。
在一项多中心、单臂Ⅱ期临床试验显示,Zepzelca单药治疗复发性小细胞癌SCLC患者的客观缓解率(ORR)为35.2%、DCR为68.6%,中位DOR为5.3个月。
小细胞肺癌患者目前仍然存在着巨大的医疗需求,Zepzelca的获批为SCLC患者带了一个新的标准方案。
②度伐利尤单抗获批一线
2020年9月,度伐利尤单抗(商品名:英飞凡)被美国FDA批准联合标准护理(SoC)含铂化疗(依托泊苷+卡铂或顺铂),一线治疗广泛期小细胞肺癌(ES-SCLC)成人患者,也是被证实与SoC含铂化疗(依托泊苷+卡铂或顺铂)联合治疗能提供显著生存益处和改善缓解率的唯一一个PD-1/PD-L1免疫疗法。
在一项名为CASPIAN的Ⅲ期临床试验中,与单独化疗相比,联合治疗组的死亡风险降低了27%、总生存期显著延长(中位OS:联合组13.0个月 VS 化疗组为10.3个月),客观缓解率为68%。此外,无论是在24个月的存活率还在24个月无进展生存率,联合组的数据都要高于单独化疗组。
可以看出,度伐利尤单抗联合化疗给小细胞癌患者带来了一个能提供持久的生存收益,又能提高肿瘤缓解率的方案。
纵观以上药物盘点,有些药物已经在国内上市,但适应症还未和国际接轨。2021年,我们期待有更多的肺癌新药在中国获批,同时已上市的药物可以扩大适应症,让更多的肺癌患者有药可用!
来源:肺癌康复圈
2021-01-06 15:48

好医友小编
联系医学顾问
医学顾问微信在线
