视神经脊髓炎谱系疾病迎来新药Enspryng,复发率降低近80%
 其它
|
阅读量:257次
其它
|
阅读量:257次
近日,FDA宣布批准Enspryng(Satralizumab-mwge)上市,用于治疗具有特定抗体(抗水通道蛋白-4,即AQP4抗体呈阳性)的成人视神经脊髓炎谱系疾病(NMOSD)。
这是近两年来,FDA批准的第三种治疗NMOSD的药物,也是首个获批用于AQP4抗体阳性NMOSD的皮下治疗方案,为这类罕见病群体提供了一种新的治疗选择。
罕见病:NMOSD
视神经脊髓炎谱系疾病(NMOSD)是一种罕见的中枢神经系统自身免疫性疾病,患者体内的免疫系统会错误地攻击体内的健康细胞和蛋白质,尤其是视神经和脊髓中的细胞和蛋白质。
所以,NMOSD主要损害视神经和脊髓,导致失明、肌无力和瘫痪。约50%的患者因NMOSD发作而引起永久性视力障碍和瘫痪。
据悉,美国约有4,000至8,000名NMOSD患者,而亚洲人群的发病率远高于白种人。NMOSD以30-50岁的女性尤为多见,正是黄金年龄,因此被称为“刽子手”。
NMOSD的复发率及致残率非常高,有数据表明,NMOSD一年复发率高达60%,五年复发率高达90%。而且,每一次复发都可能导致患者出现神经损伤和残疾加重,进而导致失明、瘫痪等,严重者甚至导致死亡。
在受访的333名NMOSD患者中,除了最常见的视力受损、肢体麻木或疼痛及疲乏症状外,64.3%的患者还存在贫血、高脂血症、甲状腺疾病等合并症。
最重要的是,目前国内尚无获批的针对性药物。患者一直面临着缺药、少药的局面,除了自身治疗方面的困难,还要面临着失业、生活不能自理的困境。该病给患者及其家庭带来了极大的经济和心理负担,亟待改善这一群体的用药窘境。
今年发布的《中国NMOSD患者综合社会调查白皮书》显示:NMOSD患者中60%接受过高等教育,却有超过1/3处于长期失业,还有超过2/3的患者生活无法自理。
创新药:Enspryng
约73%的NMOSD患者含有AQP4抗体,该抗体的补体激活可导致中枢神经系统中的重要细胞破坏,导致脱髓鞘和神经元的死亡,主要在视神经和脊髓中造成进行性和不可逆的损伤,从而导致NMOSD的复发和残疾。
Enspryng是目前唯一一款获批治疗NMOSD的白细胞介素-6(IL-6)单抗药物,IL-6信号通路在NMOSD导致的相关炎症中发挥关键作用。此前,它曾获得了FDA的快速通道认定和孤儿药称号。
临床试验
这项批准是基于两项随机对照的3期临床试验,证明了Enspryng在治疗NMOSD的有效性和安全性。
第一项研究纳入了95名成年患者,其中64名抗AQP4阳性。
结果显示,与安慰剂(非活性治疗)相比,治疗第96周时,Enspryng治疗组有76.5%的患者无复发,安慰剂组仅为41.1%,减少了74%的NMOSD复发。
第二项研究纳入76名成年患者,其中52名抗AQP4阳性。结果显示,与安慰剂相比,
治疗第96周时,接受Enspryng治疗的AQP4抗体阳性患者有91.1%无复发,安慰剂组为56.8%,减少了78%的复发。
不过,在这两项试验中没有证据表明AQP4抗体阴性的患者受益。
罕见病NMOSD领域上市新药
此前,NMOSD患者一直面临着临床治疗缺药的窘境。直到去年,首个治疗NMOSD的药物在美获批,NMOSD患者才有药可用。
截至目前,针对NMOSD这一罕见病已有三种药物在国外获批上市。此前获批的两款分别是C5补体抑制剂Soliris和B细胞消耗剂Uplizna。
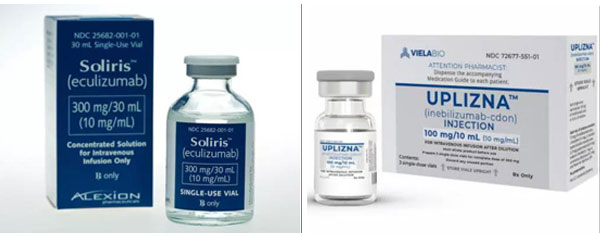
2019年6月,FDA批准C5补体抑制剂Soliris(Eculizumab)上市,治疗抗AQP4抗体阳性的NMOSD成人患者。这是NMOSD领域首个获批治疗的新药。
今年6月,FDA批准了抗CD19单抗药物Uplizna(Inebilizumab-cdon)上市,在初始剂量后作为一年2次的维持方案,用于治疗抗AQP4抗体阳性的NMOSD成人患者。
这是首个也是唯一一个被批准用于治疗AQP4抗体阳性NMOSD成人患者的B细胞消耗剂。
期待NMOSD这类罕见病新药能够早日在国内上市,填补治疗缺口!
2020-08-21 14:18

好医友小编
联系医学顾问
医学顾问微信在线
