狡猾的癌细胞,是如何给自己披上“隐形外衣”的?
 医学资讯
|
阅读量:次
医学资讯
|
阅读量:次
很早以前,科学家就注意到,细胞会像秋天的落叶那样“优雅地自我了结”。它们死得很有规律,似乎是按照编好的“程序”进行的,该过程也被称为“程序性细胞死亡”。
在健康的人体中,细胞的生生死死总是处于一个良性的动态平衡中,如果这种平衡被打破,人就会患病。如果该死的细胞没死,就可能导致细胞恶性增长,导致癌症。
癌症是众病之王,在与癌细胞的长期斗智斗勇中,人类逐渐看清了这个“敌人”的狡猾之处。
癌细胞可以通过高表达程序性死亡配体1 (PD-L1),来结合免疫T细胞表面的程序性死亡蛋白1 (PD-1)受体,导致T细胞减少增殖或失去活性,从而失去识别和打击肿瘤细胞的能力。借此,癌细胞躲过了免疫攻击,肆无忌惮地疯长。
近年来,免疫疗法的问世为癌症治疗带来了革命性巨变。包括纳武利尤单抗、帕博利珠单抗和阿替利珠单抗在内的PD-1/PD-L1抑制剂成为免疫治疗的主力军。这些药物通过不同途径抑制PD-L1/PD-1的相互作用,逆转肿瘤免疫逃逸机制,重新激活T细胞,让它恢复识别肿瘤和攻击肿瘤的能力,从而控制肿瘤进展,造就了一批又一批的癌症“超级幸存者”。

尽管这些免疫检查点抑制剂已在多种癌症(尤其是非小细胞肺癌)中发挥了显著疗效,但癌细胞究竟如何过度表达PD-L1以保护自己免受免疫系统攻击,仍是一个谜。
为此,美国德克萨斯大学西南分校的分子生物学副教授Kathryn A. O’donnell博士团队开始广泛研究,看哪些基因可能作为调节因子在非小细胞肺癌(NSCLC)中制造PD-L1。该研究结果发表在《自然·癌症》网络版上。
研究人员使用CRISPR“基因魔剪”技术,像分子剪刀一样去除特定的基因。他们分别从一个人类NSCLC细胞系中去除19000个基因,然后使用一种荧光PD-L1抗体来检测哪些细胞的PD-L1更多或更少。
借此,他们能识别那些会促进PD-L1生成的基因,即正调节基因,以及那些阻碍PD-L1生成的基因,即负调节基因。
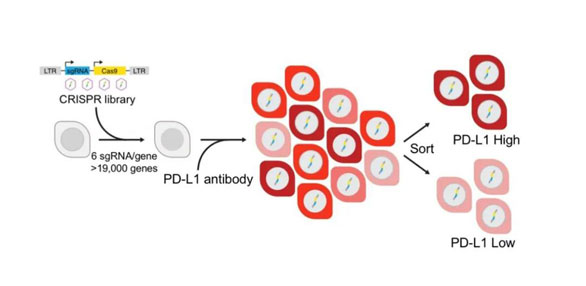
CRISPR技术(来源:UTSW)
令人惊讶的是,他们发现,制造PD-L1的有效抑制剂是一种称为UROD的基因,它在血红素的生产过程中发挥关键作用。血红素是红细胞中携带氧气的关键物质,同时也是维持体内平衡(内稳态)所必需的。为证实这些发现,研究人员使用了其他方法来去除NSCLC细胞中的血红素,这也触发了肺癌细胞产生更多的PD-L1蛋白。当将耗尽UROD的肿瘤植入健康小鼠后,它们的生长速度明显快于缺乏有效免疫系统的小鼠。
进一步的实验表明,阻碍血红素的合成,开启了一种被称为综合应激反应(ISR)的通路,这种通路被细胞广泛用于处理各种应激状况,如缺氧、毒素或营养缺乏。在这种情况下,NSCLC细胞利用一种特殊的机制,依靠一种被称为eIF5B的蛋白质来增加PD-L1的生成。即使不干扰血红素的合成,只要用这种单一的蛋白质刺激细胞,就可以增加PD-L1的生成。
研究团队通过检查各种癌症中过量生成或生成不足的基因的数据库,发现编码eIF5B的基因在肺癌中经常过量生成,这在肺癌患者中是预后不良的一个标志。
“开发专门针对这种蛋白或其他参与制造PD-L1的蛋白质的新药,有望提高现有免疫治疗药物的成功率。”O'Donnell博士说。
2020-04-27 14:28

好医友小编
联系医学顾问
医学顾问微信在线
