胰腺癌治疗新靶点,有望让癌细胞“断粮”!
 医学资讯
|
阅读量:次
医学资讯
|
阅读量:次
一项新的研究揭示了一种机制,该胰腺肿瘤通过劫持从周围环境吸收营养的过程,帮助胰腺癌细胞在致密肿瘤中提供给养。
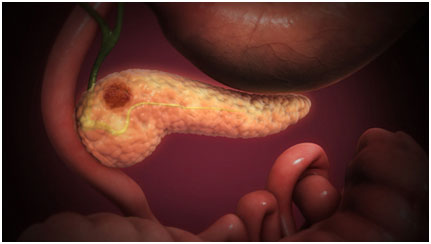
在纽约大学格罗斯曼医学院的研究人员的带领下,这项研究解释了RAS基因的变化。众所周知的是,RAS基因会导致90%的胰腺癌患者出现异常生长,也促进了提供这种生长所需的基础的过程。
这种过程称为巨胞饮作用,它吞噬蛋白质和脂肪,它们可以分解为氨基酸和代谢产物,用于构建新的蛋白质,DNA链和细胞膜。研究作者说,没有这些资源,癌细胞就无法繁殖。
这项新研究于12月11日在线发表在《自然》(Nature)杂志上,这项新研究确定了癌细胞为促进微胞饮作用所采取的关键分子步骤。
“我们发现了一种与营养供应相关的机制,我们认为该机制可用来抑制RAS突变肿瘤细胞的关键生存机制,”第一篇研究的作者Craig Ramirez博士说,他是纽约大学医学院生物化学和分子药理学博士后。
试验结果
具体来说,研究小组发现RAS突变进一步激活了SLC4A7蛋白,这使得依赖于碳酸氢盐的可溶性腺苷酸环化酶激活了蛋白激酶A。这反过来又改变了称为v-ATPase的蛋白的位置。
研究人员说,通过将v-ATPase的作用区域从细胞深处转移到靠近细胞膜的地方,这种反应使酶将RAC1所需的胆固醇附着到细胞膜上。外膜附近v-ATPase的积聚和Rac1的相关定位,使膜在巨胞饮过程中暂时鼓泡、翻滚,形成吞噬营养的囊泡。
在细胞培养研究中,用SLC4家族抑制剂S0859处理突变的RAS细胞,导致RAS依赖性v- ATPase定位于外膜的能力大大降低,并且抑制了微胞饮作用。
此外,对来自人胰导管腺癌(PDAC)组织的分子数据的分析表明,SLC4A7的基因在肿瘤中的表达比正常的附近胰腺组织高四倍。
研究小组还发现,在小鼠胰腺癌细胞中沉默SLC4A7基因可以减缓或缩小肿瘤。14天后,与有活性基因的肿瘤相比,有沉默的SLC4A7的肿瘤中62%的小鼠生长速度减慢,并且有31%的肿瘤表现出萎缩。
该研究的资深作者Dafna Bar-Sagi博士说:“我们现在正在寻找可能抑制SLC4A7或v-ATPase作用的药物候选物,这些药物可能会阻止巨细胞增多症。这两种蛋白质原则上都是良好的靶标,因为它们与癌症的生长有关,并在癌细胞表面附近运作,在癌细胞表面,通过血液输送的药物可以到达它们。”
2019-12-24 16:46

好医友小编