囊性纤维化迎来突破疗法Trikafta,90%患者不再无药可治
 其它
|
阅读量:131次
其它
|
阅读量:131次
近日,美国FDA批准了Trikafta(elexacaftor/ivacaftor/tezacaftor),这是首个治疗最常见囊性纤维化突变患者的三重联合疗法。Trikafta被批准用于12岁及以上的囊性纤维化患者,这些患者的CFTR基因(囊性纤维化跨膜电导调节器基因)中至少有一个F508del突变。在囊性纤维化人群中这部分患者约占90%。
FDA代理专员Ned Sharpless说:“在FDA,我们一直在寻找加快复杂疾病新疗法开发的方法,同时保持我们高标准的审查,今天具有里程碑意义的批准证明了这些努力。现在,大多数囊性纤维化患者,包括青少年都能获得一种新的治疗方法,而在以前他们没有选择。FDA仍然致力于为未满足患者需求的领域提出新的治疗方案,特别是影响儿童的疾病。”
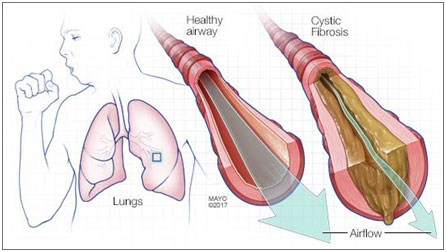
囊性纤维化是一种罕见的、进行性的、危及生命的疾病,其结果是在肺部、消化道和身体其他部位形成厚粘液。它会导致严重的呼吸和消化问题以及其他并发症,如感染和糖尿病。囊性纤维化是由CFTR基因突变带来的缺陷蛋白引起的,已知的CFTR基因突变约有2000个,但其中最常见是F508del突变。
Trikafta是三种针对CFTR缺陷蛋白的药物组合,它有助于CFTR缺陷蛋白更有效地发挥作用。目前针对缺陷蛋白的治疗方法只对少数患者有效,trikafta是首个被批准的治疗12岁及以上且至少有一个F508del突变的的囊性纤维化患者,该突变影响90%的疾病人群,在美国合计约27000人。除了被授予快速通道、突破性治疗指定和优先审查外,Trikafta还获得了FDA孤儿药物指定。
Trikafta的疗效在两项临床试验中得到了证实。第一项是为期24周的随机双盲安慰剂对照试验,受试对象是403名F508del基因突变和第二个等位基因突变导致无法产生CFTR蛋白或CFTR蛋白对ivacaftor或tezacaftor/ivacaftor无反应的患者。第二项是为期四周的随机双盲主动对照试验,研究对象是107名有两个相同F508del突变的患者。
试验中主要的分析着眼于预测的一秒钟内呼气容积百分比的增加,称为ppFEV1,这是囊性纤维化肺病进展的一个确定标志。Trikafta在两项试验中均增加了ppFEV1。在第一项试验中,与安慰剂相比,ppFEV1比基线水平提高13.8%。在第二项试验中,与tezacaftor/ivacaftor相比,ppFEV1比基线水平提高了10%。第一项试验中Trikafta还改善了患者的汗液氯化物、肺部恶化次数(呼吸症状和肺功能恶化)和体重指数。
Trikafta的安全性基于两项试验中510名囊性纤维化患者的数据,所有亚组患者的安全性基本相似。与安慰剂相比,接受Trikafta治疗的患者出现更多的严重药物不良反应是皮疹和流感事件。最常见的不良反应包括头痛、上呼吸道感染、腹痛、腹泻、皮疹、肝酶(丙氨酸转氨酶和天冬氨酸转氨酶)升高、鼻塞、血肌酸磷酸激酶升高(一种与肌肉损伤有关的酶)、鼻漏、鼻炎、流感、鼻窦炎和血胆红素升高(可能由涉及肝脏、胆囊或红细胞的问题引起)。
囊性纤维化患者应与专业医护人员交谈,并进行测试,以了解他们有哪些基因突变。患者应至少有一个F508del突变。Trikafta治疗12岁以下囊性纤维化患者的安全性和有效性尚未确定。
来源:FDA官网
2019-11-14 15:55

好医友小编
联系医学顾问
医学顾问微信在线
