抗体药物Padcev上市,治疗膀胱癌,死亡风险减低30%
 膀胱癌
|
阅读量:200次
膀胱癌
|
阅读量:200次
近日,抗体偶联药物Padcev(Enfortumab Vedotin- ejfv)在美国由加速批准转换为常规批准。
此外,美国FDA还授予其一项扩展适应症,用于治疗不适合于含铂化疗的局部晚期或转移性尿路上皮癌(UC)成年患者,且此前已接受过一种或多种疗法。
这是FDA批准的首个也是目前唯一一个针对含铂化疗反应不足且既往接受过一种或多种疗法的UC疗法。

▌膀胱癌二线治疗失败怎么办?
目前,全球每年报告的膀胱癌新病例约为57.3万例,死亡人数超过21.2万人。其中,尿路上皮癌(UC)是最常见的膀胱癌类型,约占所有膀胱癌的90%。
晚期UC患者的一线标准治疗是含铂化疗,多数患者可从初始化疗中受益。而一线化疗失败或者不符合化疗条件的患者,将继续接受PD-1或PD-L1抑制剂治疗。
不过,约80%的晚期患者对二线免疫治疗无应答反应,预后较差,临床获益需求得不到满足。
此前,抗体偶联药Trodelvy获加速批准,治疗UC。如今,另外一种抗体偶联药Padcev已转为常规批准,为一、二线治疗失败的复发转移患者带来新的治疗希望。
▌抗体偶联药物:Padcev
Padcev是一种抗体药物偶联物(ADC),靶向连接蛋白-4(Nectin-4),这是一种位于细胞表面的蛋白质,在膀胱癌中高表达。
Nectin-4在多种肿瘤细胞中过度表达,如尿路上皮癌、乳腺癌、胰腺癌、膀胱癌等。因此,该蛋白已经成为一种热门的治疗靶点。
Padcev进入细胞后,与表达Nectin-4的细胞相结合,然后将偶联物微管破坏剂MMAE(单甲基auristatin E)内化并释放到细胞中,进而导致细胞死亡。
2019年,Padcev获FDA加速批准,用于治疗局部晚期或转移性UC患者,这些患者既往在手术前/后接受过PD-1 / L1抑制剂治疗、或一种含铂化疗。
▌死亡风险减低30%,UC患者存活更长!
Padcev从加速批准转换为常规批准,是基于EV-3013期试验的数据。
EV-301试验是一项全球性、多中心、开放标签、随机3期试验,旨在608名局部晚期或转移性尿路上皮癌患者中,评估Padcev与化疗的疗效和安全性,这些患者先前接受过铂类化疗和PD-1/L1抑制剂治疗。
主要终点是总生存期,次要终点包括无进展生存期、总缓解率、缓解持续时间和疾病控制率,以及安全性/耐受性等。
发表在《新英格兰医学》杂志上的数据显示:
在预先指定的中期分析中,与接受化疗的患者相比,接受Padcev治疗的患者死亡风险降低30%。
治疗组和化疗组的中位总生存期分别为12.9个月和9.0个月;中位无进展生存期分别为为5.6个月和3.7个月;总体缓解率分别为40.6%和17.9%。
▌一半患者获得缓解,试验数据亮眼!
EV-201试验是一项单臂、多队列、多中心、关键2期临床试验,入组了多名既往接受过PD-1或PD-L1抑制剂治疗的局部晚期或转移性尿路上皮癌患者。
包括125名接受过含铂化疗的患者(队列1),以及89名未接受过含铂化疗且不符合化疗治疗条件的患者(队列2)。
主要终点是客观缓解率。次要终点包括对反应持续时间、疾病控制率、无进展生存期、总生存期、安全性和耐受性的评估。
结果显示:
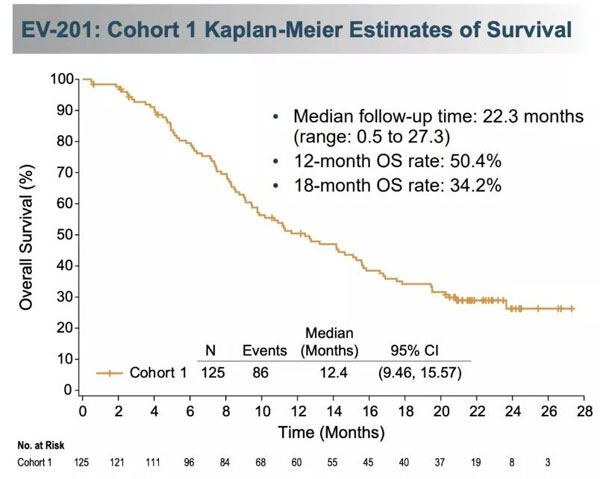
在队列1中,Padcev治疗组患者的客观缓解率为44%,中位缓解持续时间为7.6个月。治疗一年后仍有一半多的患者持续缓解。
在队列2中,中位随访16个月后,治疗组患者的客观缓解率为51%;中位反应持续时间为13.8个月。
约一半的晚期膀胱癌患者无法接受基于顺铂的化疗,其中,许多患者接受一线免疫治疗后没有反应或疾病仍进展。
而抗体偶联药物Padcev的获批,满足了这类难治性患者临床获益的治疗需求,造福了更多的尿路上皮癌患者。
2021-07-14 10:08

好医友小编
联系医学顾问
医学顾问微信在线
