丙肝联合疗法获FDA突破性疗法认定
 感染性疾病
|
阅读量:104次
感染性疾病
|
阅读量:104次
日前,艾伯维公司宣布该公司由glecaprevir与pibrentasvir (G/P) 构成的丙肝联合疗法获得美国FDA授予的突破性疗法认定 。这一认定的适应症是基因1型的慢性丙型肝炎,并且对其它“直接作用抗病毒药物”(Direct-Acting Anti-viral, DAA)疗法有失败经历的患者。突破性疗法认定将加快该项疗法的开发和审批过程。

根据世界卫生组织统计,全世界有1.3~1.5亿人受到慢性丙肝病毒感染。很多慢性丙肝患者会出现肝硬化和肝癌,从而导致每年约有70万人死于与丙肝相关的肝脏疾病。目前,丙肝疫苗尚未问世,但是抗病毒药物能够治愈90%以上的丙肝患者。以前,标准的丙肝治疗方法为干扰素加ribavirin。不过近年来“直接作用抗病毒药物”逐渐成为丙肝治疗的首选——通过对丙肝病毒复制周期和基因的深入研究,制药公司研制出直接靶向丙肝病毒复制过程中担任重要功能的那些蛋白的小分子抑制剂,这些DAA能够有效地抑制丙肝病毒的复制。但是由于丙肝病毒是一种很容易突变的病毒,单一DAA的使用很容易会筛选出对这种DAA产生抗性的病毒。因此,将多种DAA联合使用能减少丙肝病毒抗性的产生,也逐渐成为主流的治疗方法。
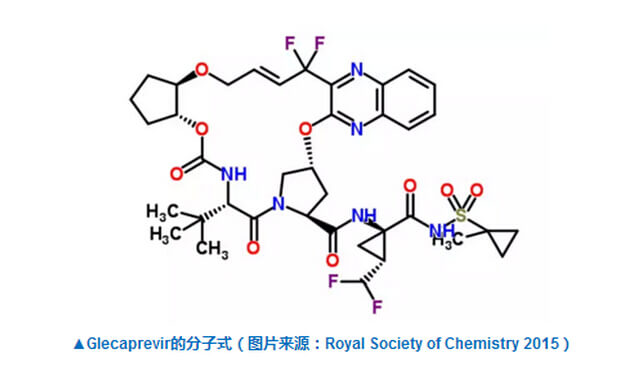
艾伯维的这款治疗方法也是两种DAA的组合。Glecaprevir是一种NS3/4A蛋白酶的抑制剂,而pibrentasvir是一种NS5A抑制剂。NS3/4A和NS5A都是在丙肝病毒复制过程中必需的复制复合体的重要组成部分。在已经结束的称为麦哲伦-1的2期临床试验中,G/P联合疗法在已经有过DAA疗法失败经历的基因1型慢性丙肝患者中疗效显著,95%的患者在为期12周的疗程结束后,体内丙肝病毒下降到无法测出的水平,并且可以维持12周以上。
此外,G/P联合疗法对所有主要基因型的丙肝病毒疗效都非常显著。艾伯维名为SURVEYOR-1和SURVEYOR-2临床II期试验结果表明,对于未接受过治疗,没有肝硬化症状的基因1-3型丙肝患者,疗程为8周的G/P联合疗法有效率达到97%以上。而疗程为12周的G/P联合疗法对未接受过治疗或只接受过干扰素治疗的基因3-6型丙肝患者的有效率为100%。 正是因为这样优异的结果,FDA授予了它突破性疗法认定。
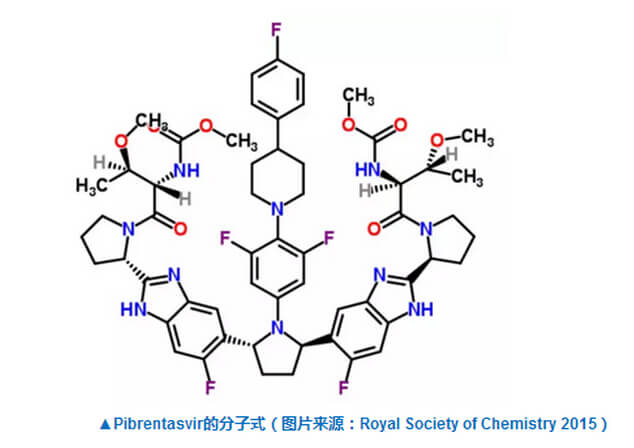
“艾伯维将致力于进一步推动丙型肝炎的医疗护理,解决广大慢性丙肝患者还未被解决的医疗需求,”艾伯维的首席科学官兼研发执行副总裁Michael Severino博士说。G/P联合疗法目前正在进行3期临床试验,试验结果将在即将举行的科学会议上公布。
参考资料:
[1] AbbVie’s Investigational HCV Regimen Receives U.S. FDA Breakthrough Therapy Designation
[2] AbbVie’s Investigational, Pan-Genotypic Regimen of ABT-493 and ABT-530 Shows High SVR Rates in Genotype 1 Hepatitis C Patients Who Failed Previous Therapy with Direct-Acting Antivirals
[3] AbbVie Presents New Phase 2 Data for Investigational, Once-Daily, Ribavirin-Free, Pan-Genotypic Regimen of ABT-493 and ABT-530 for Hepatitis C Genotypes 1-6
[4] 丙型肝炎-世界卫生组织
来源:药明康德
2018-11-16 15:00

好医友小编
联系医学顾问
医学顾问微信在线
